10 Apr Mitohondrijsko doniranje
Mitohondrijsko doniranje je jedan od programa IVF, tehnologija mitohondrijalne manipulacije, MMT, terapija je zamjene mitohondrija, prenos pronukleara, prenos vretena majke, prenos ooplazme, prenos citoplazme, beba sa tri roditelja.
IVF metoda tokom koje se oštećeni mitohondriji žene zamjenjuju doniranim mitohondrijima radi spriječavanja mitohondrijskih bolesti.
Tehnike doniranja mitohondrija stvaraju djecu rođenu sa nuklearnom DNK od spermatozoida i jajnih ćelija njihovih roditelja, kao i zdrave mitohondrije od donatora jajnih ćelija, koji nisu povezani sa majkom. Tehnike doniranja mitohondrija djeluju kao neobavezna terapija za uklanjanje mitohondrijskih mutacija, omogućavajući tako rađanje zdrave djece bez mutacija mitohondrija, jer mitohondriji imaju svoj vlastiti skup DNK (mtDNA) odvojen od ostatka našeg tijela koji se nasleđuje po ženskoj liniji .
Donacija mitohondrija moguća je na tri glavna načina:
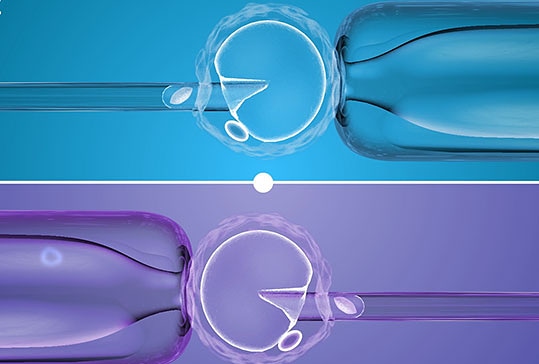
✔Pronuklearni prenos
Ključna razlika je u tome što se pronuklearni prenos (PNT) javlja nakon oplodnje. Uključuje stvaranje i upotrebu embriona, tačnije zigota starih 1 dan (od kojih se jedna odbacuje). Majčino jaje je oplođeno očevom spermom i formira se zigota sa dva pronukleusa. Zigota sadrži neispravne mitohondrijske gene majke. Roditeljska DNK ima oblik dva pronukleusa. Dalje, potrebno nam je donatorsko jaje koje sadrži mitohondrije bez defekata. Donatorska jajna ćelija oplođena je očevom spermom i formirana je druga zigota. Druga zigota ima zdrave mitohondrije i takođe dva pronukleusa. Ovi pronukleusi (donor i otac) se uklanjaju i zamenjuju pronukleima iz prve zigote (majka plus otac). Dobijena zigota sadrži nuklearnu DNK majke i oca i zdrave mitohondrije donatora.
✔Prenos vretena majke
Ovaj proces uključuje tehniku genetske manipulacije gdje se nuklearna DNK davaoca, ali ne i njena mitohondrijska DNK, prenosi u primajuće jaje. Tehnika uključuje uzimanje nuklearne DNK iz jajne ćelije i prenos te DNK u drugu jajnu ćeliju, ostavljajući oštećenu mitohondrijsku DNK iza sebe. Zatim se ćelija implantira tehnikama oplodnje in vitro. Konačna mitohondrijska DNK je, međutim, iz jajne ćelije koja prima, što dovodi do toga da mitohondrijska DNK originalnog davaoca ne bude proslijeđena potencijalnom potomstvu.
✔Prenos ooplazme
U ovoj vrsti doniranja mitohondrija, dio ooplazme (citoplazma jajeta) sa zdravim mitohondrijama postavlja se iz donatorskog jajeta u jaje primaoca sa oštećenim mitohondrijima. Ooplazma, uključujući mitohondrije iz svježih, zrelih ili nezrelih, ili odmrznutih krio-konzerviranih jajnih ćelija (po mogućnosti od mlađe žene) direktno se ubrizgava u oocite primaoca modifikovanom ICSI tehnikom da bi se poboljšala održivost jajnih ćelija. Dobijena zdrava jajna ćelija je oplođena, a zatim implantirana u matericu (obično u jajnu stanicu primaoca). Ova metoda se koristi sa povjerenjem jer se pokazalo da je citoplazmatska manipulacija oocitima i ranim embrionima kompatibilna sa normalnim razvojem.
Pravni aspekti
Donacija mitohondrija uključuje prenos genetskog, ali ne i nuklearnog materijala, što je dovelo do nesigurnosti da li treba da se reguliše kao doniranje jaja ili kao doniranje tkiva. Mitohondrije igraju važnu ulogu u mnogim tjelesnim procesima, pa bi genetski doprinos davaoca mogao biti značajan: postoje složene interakcije između nuklearne DNK i mitohondrijske DNK, a organeli sadržani u citoplazmi mogli bi uvesti epigenetske promjene u nuklearnu DNK.
Zakon propisuje ko ispunjava uslove za upotrebu tehnika: žene u riziku od prenošenja mitohondrijske bolesti na svoje potomstvo. To bi značilo da onima koji žele da koriste tehnike za poboljšanje plodnosti i lezbijskim parovima koji žele da ih koriste kako bi dijete imalo genetski doprinos od oba (jedan bi bio davalac mitohondrija) neće biti dozvoljeno.
Ujedinjeno Kraljevstvo je postalo prva država koja je legalizovala postupak nakon što su Parlament i Dom lordova odobrili Pravilnik o ljudskoj oplodnji i embriologiji (donacija mitohondrija) u februaru 2015. godine, a koji su stupili na snagu 29. oktobra 2015. Trenutni propisi u Velikoj Britaniji da mitohondrijske IVF tehnike treba ograničiti na odabrane slučajeve kada „postoji poseban rizik da pacijentovo jaje ili embrion stvoren pomoću pacijentovog jajeta nosi mtDNK abnormalnost i da postoji značajan rizik da dijete rođeno od upotrebe tog embriona će imati ili razviti ozbiljnu mitohondrijsku bolest “. Upotrebu pomno nadgleda Uprava za ljudsku oplodnju i embriologiju te zemlje (HFEA), koja reguliše potpomognutu reprodukciju i istraživanje embriona.
U SAD se još uvijek raspravlja o legalnosti tehnika manipulacije mitohondrijama.
Etički aspekti
Drugo područje kontroverze je uticaj tehnika na ljudski genom. Ministarstvo zdravstva Velike Britanije identifikovalo je da su tehnike podrazumijevale modifikaciju germinativne linije, „tako što će se rezultat doniranja mitohondrija – izbjegavanje prenosa ozbiljne mitohondrijske bolesti – prenijeti na buduće generacije“. Zaključeno je da tehnike ne uključuju genetsku modifikaciju; ne postoji univerzalno dogovorena definicija „genetske modifikacije“ kod ljudi – ljudi koji imaju transplantaciju organa, davanje krvi ili čak gensku terapiju uglavnom se ne smatraju „genetski modifikovanim“. Iako ne postoji univerzalno dogovorena definicija, Vlada je odlučila da usvoji radnu definiciju u svrhu unapređenja ovih propisa. Radna definicija koju smo usvojili je da genetska modifikacija koja uključuje modifikaciju zametne linije nuklearne DNK (u hromozomima) može da se prenese na buduće generacije. Čini se da su protivnici uredbe zabrinuti da će ona dovesti do stvaranja „beba dizajnera“. Drugi etički problem je kako sprečiti druge moguće upotrebe tehnike.
Genetski će dijete zaista imati DNK od tri osobe, ali svi dostupni naučni dokazi ukazuju da geni koji doprinose ličnim karakteristikama i osobinama potiču isključivo iz nuklearne DNK, koja će poticati samo od majke i oca predloženog djeteta. Donirana mitohondrijska DNK neće uticati na te karakteristike. Ako se smatra da naš karakter i fizički izgled isključivo određuju naši nuklearni geni, onda kao što je predložilo Ministarstvo zdravlja, promjena mitohondrijskih gena možda neće imati značajan uticaj na dijete. Ali mnogi odbacuju ovu vrstu genetskog esencijalizma. Identitet je teško definisati, ali to je više od našeg karaktera i fizičkih osobina. Reproduktivna medicina dodatno komplikuje pitanja identiteta. Rođenje bez mitohondrijske bolesti imalo bi, naravno, značajan uticaj na dijete.
Svaku djecu rođenu tehnikom treba dugoročno nadgledati. Za to je potrebno odobrenje roditelja; s druge strane, ne možete dati pristanak za ljude koji još nisu začeti.
Propisi koji se predlažu zadržaće zabranu promjene ove nuklearne DNK. To znači da se tehnika ne može koristiti za odabir boje kose, osobina ličnosti, inteligencije ili bilo koje druge karakteristike povezane sa stvaranjem „dizajnerskih beba“.
Genetski će dijete zaista imati DNK od tri osobe, ali svi dostupni naučni dokazi ukazuju da geni koji doprinose ličnim karakteristikama i osobinama potiču isključivo iz nuklearne DNK, koja će poticati samo od majke i oca predloženog djeteta. Donirana mtDNK neće uticati na te karakteristike – genetski doprinos druge žene je toliko mali, samo 0,01%, da nije mogla.
Druga važna stvar je da su geni u mitohondrijima potpuno odvojeni od gena u jezgru i ne mogu se međusobno kombinovati. Jedini geni na koje bi tehnika uticala bili bi oštećeni mitohondrijski geni. Dijete rođeno pomoću ove tehnike i dalje bi dobijalo sav svoj nuklearni genetski materijal – kontrolišući njegove fizičke i psihološke osobine – od majke i oca. Djeca rođena nakon mitohondrijskog prenosa bila bi bez mitohondrijske bolesti – i na kraju bi ovu zdravu mitohondrijsku DNK prenijela na svoju decu.
Važno je da se težina bolesti kod potomaka ne može predvidjeti na osnovu težine bolesti majke. Jedan od razloga za to je „teorija uskih grla“. Pojednostavljeno, replikacija mitohondrijske DNK između ćelija i preraspodjela tokom sazrijevanja jajašca može dovesti do ekstremnih razlika u nivoima mutacije. To znači da asimptomatska majka može imati dijete koje je teško ili smrtno pogođeno. Mnogi roditelji, čije su priče bile u fokusu mitohondrijske rasprave, nisu znali da im prijeti rizik da imaju dijete sa mitohondrijskom bolešću sve dok im djetetu nije dijagnostikovana.
Generalno, od većine somatskih ćelija koje bi se dobile od reproduktivno zrelog davaoca oocita očekuje se da sadrži delecije i mutacije mitohondrijske DNK. Takva mitohondrijska DNK ne bi se smatrala sigurnom za potomstvo, jer bi prenos ovih mutacija i delecija na cijelo embrionalno tkivo predstavljao potencijalni rizik. Čini se da mitohondriji somatskih ćelija negativno utiču na razvoj embriona.
Autologni mitohondriji dobijeni iz sopstvenih granuloznih ćelija pacijenta korišćeni su za uspješno poboljšanje ishoda plodnosti. Međutim, izražena je zabrinutost zbog upotrebe mitohondrija somatskih ćelija, jer bi se očekivalo da sadrže tačkaste mutacije i delecije, slično svim ostalim somatskim ćelijama. Pored toga, smrtni (apoptotični) signali iz mitohondrija unutar granuloznih ćelija kontrolišu folikularnu atreziju i sprečavaju razvoj oocita. Stoga bi se njihov prenos tokom ICSI mogao pokazati štetnim za oocit. Kvalitetni, autologni mitohondriji moraju se koristiti za povećanje energije oocita putem mitohondrijskog prenosa. Prenos iste mtDNK dobijene iz ćelija prekursora oocita smanjio bi moguće ugrožene funkcije oksidativne fosforilacije koje bi mogle nastati miješanjem mtDNA genotipova. Zbog činjenice da su se ove ćelije diferencirale prema lozi oocita, ali nisu provele godine u postmitotičnom stanju, ove ćelije mogu da se koriste kao izvor tkivo specifične, autologne mitohondrijske DNK bez mutacija i delecija.
Nakon transfera ooplazme donatora tokom ICSI-a, primijećena su poboljšanja u formiranju embriona, implantaciji i živorođenima. Izbor pacijenata ne zasniva se samo na starosti majke, već na onima koji su prethodno pokazali lošu stopu cijepanja embriona i morfološke anomalije. Smatra se da su ovi faktori reprezentativni za neadekvatnu funkciju mitohondrija. Kako se postižu živorođena deca zdrave dkece, ovaj metod je predložen za povećanje aktivnosti rezidentnih mitohondrija u ugroženim oocitima.
Obrađene su koristi od prenosa ooplazme i pokazano je da je izvor donatorske citoplazme glavni faktor uspjeha ili neuspjeha. Zbog bliske funkcionalne zavisnosti mitohondrija od nuklearnog genoma, tip ćelije koji se koristi za prenos donatora je od primarne važnosti i treba da bude usko povezan sa ćelijom primaocem radi optimalne koordinacije mtDNK i nuklearne DNK. Pokazalo se da ćelije diferencirane u jajnicima ili oocitima daju najveću stopu uspjeha u prenošenju donatorske citoplazme koja sadrži zdrave mitohondrije u oocite oštećene kvalitetom. Tretmani za povećanje zdrave mitohondrijske populacije putem ooplazmatskog prenosa iz nekompromitovanih ćelija ne bi koristili samo majkama da prevaziđu probleme sa plodnošću, već i djeci pogođenih majki koje inače mogu naslijediti mitohondrije sa nedostacima i neoptimalnom funkcijom.
Postoje alternative doniranju mitohondrija. Međutim, doniranje jajnih ćelija ne nudi mogućnost genetski povezanog djeteta i oslanja se na zalihe donatorskih jajnih ćelija, a prenatalna dijagnoza i genetska dijagnostika prije implantacije imali bi ograničen uspjeh za one koji imaju mitohondrijsku bolest ooplazme.
